フォーラムへの返信
-
投稿者投稿
-
@kensho_2021pham
キーマスターokazaki yoshihisa先生
コメント有難うございます。
はい、Nature誌に最近でていた論文です。下記ブログのURLを貼っておきます。
マイクログリアによる神経活動のフィードバック抑制|けむ@毎日論文紹介@22:00
Twitterでは毎日論文紹介をパワーポイントで紹介中 https://twitter.com/kensho_2021pham タイトル 『Negative feedback control of neuronal activity by microglia』 …
グリオーマはグリア細胞の悪性腫瘍化したものですが、
神経細胞のような振る舞いも、グリア細胞のような振る舞いも、増殖もできるという
絶望的な能力の持ち主です。
先生がおっしゃっているブログの論文は、ガン細胞関連ではありませんが、
マイクログリアというグリア細胞の一種がシナプス伝達活動を調節しているよ、という論文です。
神経伝達の可塑性には、グリア細胞(アストロサイトやマイクログリア)が関わっていることは
近年広く知られるようになっております。
グリオーマは、もはやグリア細胞でも神経細胞でもない異種なので
特定の分子標的はその他の正常細胞も大きく傷つけ得るので本当に治療が難しいように感じました。
okazaki yoshihisa
キーマスター追伸です。
G47Δはこちらです。
グリーオーマに効果ありとのことですが、実際どうなのでしょうか?
関心あります。御専門の大須賀先生のご意見とか聞けると嬉しいです。
okazaki yoshihisa
キーマスターお返事ありがとうございます。
可能な限り腫瘍細胞特異的に感染しCD19tを発現させることが求められると思います。
腫瘍溶解ウイルス治療用の、腫瘍特異性をupさせる方法は、下記とかいかがでしょうか?
実際に現場で使ったり、研究しているわけではないので。。。すみません。
東大医科学研究所:藤堂先生
阪大医学部;金田先生 などが御高名です。
藤堂先生が開発されておられる、G47Δ、確かグリオーマに対して薬事申請だされていたような記憶があります。
okazaki yoshihisa
キーマスターご紹介ありがとうございます。
先生のブログへのリンク紹介もありがたいです。
IFN-γは抗腫瘍効果(良い面)しかないと思い込んでました。
腫瘍環境は”ナカナカ”ですね。
固形腫瘍へのCAR-T療法。。。意外と苦戦するかもしれませんね。
okazaki yoshihisa
キーマスターご紹介ありがとうございます。
先生の論文紹介ブログに、グリア細胞がニューロンの活動を抑制している。
つまり、脳の神経活動にも積極的に関与している論文の紹介ありませんでした?
これ、一種のグリア細胞⇔ニューロンの可塑性でしょうか?
がん幹細胞にも可塑性があるようで、、、がん生物学の絶望的な複雑さを感じます。
@kensho_2021pham
キーマスターokazaki yoshihisa先生
大変興味深い論文紹介有難うございます。
腫瘍溶解ウイルス(ウイルスコンピュータ)というものを初めて知りました。
ガン細胞に、標的抗原を付加するストラテジーは大変面白いと感銘を受けました。
一つ質問なのですが、ガン細胞への標的抗原発現誘導の特異性(つまり他の細胞への感染がない)は、
腫瘍溶解ウイルスがもつ何か特性(感染経路など)によるものなのでしょうか。そのあたりの詳細なメカニズムは、
やはりoff-target細胞感染からのCAR-T-on-target副作用につながる懸念をぬぐってくれる気がしたので。
@kensho_2021pham
キーマスター沢山の質問に答えていただき有難うございます。
お陰様で理解が深まりました。
(返信は不要です)
Twitter上で毎日論文紹介していますので
宜しければコメントなどお願い致します。
YOSHIDA Haruka
キーマスター@kensho_2021pham 様
ご返事頂きありがとうございます。
変異型p53のロジックはその通りだと思います。ただ、p53R170HノックインマウスにおけるCk1a欠損時のp53安定性の向上は、Wnt-siganalとの因果関係についてまでは言及していなかったと思います。そのため、私自身は腸がんマウスにおける変異をいれたp53の安定性は、Wntとの関係性を保留にしたまま読み進めておりました。既に報告がある部分もあるかと存じますので、もし何かご存知の方がいらっしゃればご教授いただければ幸いです。
ポリフェノール類の吸収や代謝効率については不明な部分が多いようですが、カテキンにおいてはガロン酸を含むものの方が含まないものに比べて吸収されにくいとされる報告もあるようです。腸内細菌による代謝を経る場合だけでなく、腸の粘膜から直接吸収されるものもありますが、個体がもつ腸内細菌叢の影響も大きいと思いますので中々評価が難しいのが現状だと思います。
@kensho_2021pham
キーマスターYOSHIDA Haruka様
ご返信が遅くなり申し訳ありません。研究背景から大変丁寧にご説明していただき有難うございます。
Wnt活性化⇒p53R172Hの安定性の増すのですね。
CK1a欠損⇒Wnt活性化⇒通常p53はWntシグナルの標的遺伝子を抑制する(PSIS)⇒Wntターゲット遺伝子(myc)が駆動されない
CK1a欠損⇒Wnt活性化⇒p53欠損によりWntシグナルの標的遺伝子が駆動⇒Wntターゲット遺伝子(myc)が駆動する
CK1a欠損⇒Wnt活性化⇒p53R172Hは安定性が増すので、PSISが高まりWntターゲット遺伝子(myc, cyclin D1)が全く駆動されない
p53R172HにPSISがあるは、Wntシグナルのβ-カテニン-TCF4の結合能が低下しているため。
mycとcyclin D1の挙動に少し違いがあるようですね。
大変理解が深まりました。上記の流れ間違ってないでしょうか。頭が途中で混乱しました。
ガロン酸はポリフェノールの仲間なのですね。有難うございます。
食べたものは、消化管で分解や吸収を受けるので空調や回腸の段階で口から摂取したものがどのくらい残るのだろう。
という単純な疑問があります。
一方で、食物繊維はヒトは分解できないので腸内細菌のエサになると考えられており、その代謝物としてガロン酸のような
ものが放出されているのかなという疑問です。真相は全く分かりません。
今後ともよろしくお願いいたします。
YOSHIDA Haruka
キーマスター@kensho_2021pham 先生
ご質問頂きありがとうございます。質問を頂くと、私自身の勉強になりますし、他にご覧になられた方にもなにかの足しになることもあると思いますので、大変うれしく思います。
さて、まず最初の質問ですが、p53がWnt-signal pathwayを阻害することは一般的には認識されていないと思われます。
腸上皮特異的にCK1aを欠損させるとWnt活性化がみられますが、この時に変異型p53の安定性が増すことに彼らは気付きます。この論文を報告した研究室ではp53の転写因子としてのがんへの関与に着目しているようで、以前にCK1a欠損による腸がんの誘導にp53機能の欠損が必須で、それはWntのターゲット遺伝子らがp53によって抑制されるためであり、それらをPSIS(p53-suppressed invasiveness signature)として同定したことを報告しています。そのことを踏まえ、今回の論文でも実際にp53欠損腸がんマウスでPSISの発現が上昇することを確認しています。その一方で、p53R172H変異マウスでは発現上昇はみられず、トランスクリプトーム解析でも同様の結果を得ています。
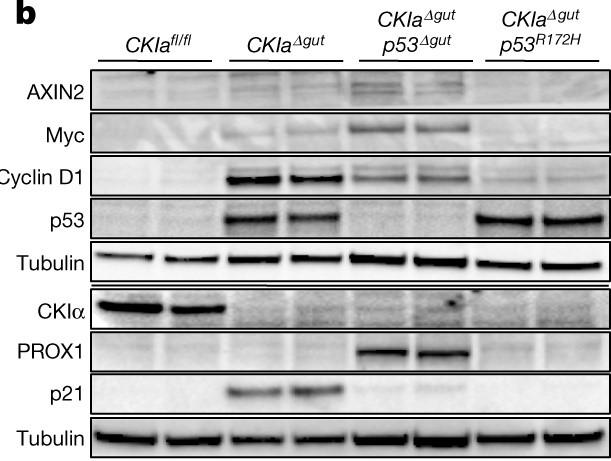
下のFig.2bのImmunoblot図では、Wntの標的遺伝子であり細胞の増殖に関与するMycやCyclin D1がWT腸がん(左から2列目)とp53欠損(左から3列目)で発現しているのに対し、p53R172H変異(左から4列目)ではほとんど発現していないことが分かります。AXIN2はWnt-signalを介在する遺伝子です。
Wnt-signal pathwayはβ-カテニンが核移行し、TCF( T cell factor)などと複合体を形成することで転写活性をもつことがしられています。このTCFの中で、腸上皮で特に多いとされるTCF4に着目し、さらに詳しいメカニズムを解明するために、彼らはChip-seqを行ってWntのターゲット領域のクロマチンにTCF4が結合しているかどうかやヒストン修飾を調べました。その結果、p53R172H変異マウスの空腸でのみTCF4の結合の低下やH3K4me3の減少が確認されました(つまりWnt-siganalのターゲット遺伝子の発現が低下)。
説明が長くなりましたが、以上の結果から、R172H変異型p53は空腸上皮におけるTCF4を介したエピジェネティック制御の阻害作用によってWnt-signal pathwayの標的遺伝子の発現を抑制するメカニズムが示唆されると思います。
2つ目のガロン酸についてですが、漢字では没食子酸(もっしょくしさん)と呼ばれていて、ポリフェノールの仲間になりますので、脂肪酸とは異なる分類になるかと思います。ガロン酸5分子がグルコース1分子とエステル結合したものがポリマーになったものがタンニンです。植物には含まれているものが多いので、日常的に少量は摂取していると思われます。食品加工学的には誘導体の没食子酸プロピルがバターなどに酸化防止剤として使われていたかと思います。また、中性脂肪や血糖値の上昇を抑える効果で機能性表示食品としての登録があります。
栄養補助食品(いわゆるサプリメント)がいくつもあるようなので、仮にガロン酸を投与するとなればそれほど難しいことではないと感じました。因みに、テアフラビンというポリフェノールからガロン酸を産生する細菌株としてLactobacillus plantarumとBacillus subtilisの2つがヒトの腸内細菌で確認されているようです。
okazaki yoshihisa
キーマスターギルバート先生の新書のご紹介ありがとうございます。
購入してみます。
ギルバート先生、反還元主義者として知られ、視点が新鮮です。
@kensho_2021pham
キーマスターYOSHIDA Haruka様
大変興味深い論文紹介有難うございます。
私は、ガンも腸内細菌もあまり詳しくありませんので、妙な質問をしてしまうかもしれませんがご了承ください。
頭の整理をしながら質問させていただきます。
Wntシグナル駆動マウスかつp53欠損となると、大腸ガンが大変なことになる。
一方で欠損ではなくp53R172H変異では、腸の中でも場所によって、ガンがむしろ抑制されたりする。
疑問①:これは変異型p53にはWntシグナルの阻害作用があるということでしたが、下流にはどういう分子メカニズムがあるのでしょうか?Wntシグナルの抑制が一般的に言われていることなのであれば、頭に入れておきたいと思いましたので。
次に、この場所による違いは腸内細菌の構成、特にガロン酸を分泌できる細菌叢がいるところでは顕著にガンができてしまう。ガロン酸がp53R172HのWntシグナル阻害を邪魔するから。
疑問②とても興味深いです。ガロン酸、初めて聞きました。脂肪酸の一種でしょうか。腸内細菌の代謝産物ということは、食物繊維などの中にもガロン酸を産生しやすいものなどがありそうですが、どうなんでしょうか?
よしだ様のおっしゃられるように、ミューテーションの種類を事前に診断することが、メカニズムベースの治療には必須だと感じました。この論文はまたじっくり読みたいと思います。
ご紹介ありがとうございました。
YOSHIDA Haruka
キーマスターコメントして頂きありがとうございます。
大須賀覚 先生
ありがとうございます。是非今後も参加させて頂きたいと思います。
論文についても、先生の仰る通り、言われてみれば、ですね。最近は動物モデルを用いた基礎研究でも臨床との関係性を仄めかすFigureをひとつ入れないとトップジョーナルに掲載されない傾向があると感じていましたが、そうした発見の新規性が評価されたのかもしれません。
okazaki yoshihisa 先生
貴重なご意見ありがとうございます。『ギルバート発生生物学』は色々な理由から中々手が出ませんでしたが、是非読んでみたいと思います。
蛇足ですが、用土社からギルバート氏の講義形式での書籍が来月に出版されるようです。
okazaki yoshihisa
キーマスター詳細なレポありがとうございます。
今回の論文のような現象、大変興味をひかれます。
がん生物学分野では、発癌は大御所Vogelstein先生の"多段階発癌説”が教科書的定説ですが、
個人的にはもっと奥が深い生命現象ではないかと感じています。
発癌と遺伝子の関係の面白い例:ギルバート著『発生生物学』第4章などに載っています。
遺伝子の意味=周辺環境との相互作用(腸内細菌叢など)との文脈で最終的に決まる!!
今回のように、同じ遺伝子変異でも、文脈によっては全く逆の意味を現すこともある。
今後ともよろしくお願いいたします。
大須賀覚
キーマスター最新論文フォーラムにご参加くださって、誠にありがとうございます!新たな人に参加してもらい、本当に嬉しいです!!
ぜひ、今後とも引き続いて報告をお願いいたします。この量の報告をまとめるのも大変な作業でしょうから、もう少し要点だけでも構いませんので、ご無理をなさらない範囲で継続的にご参加いただければと思います。
さて、ご紹介いただいた論文ですが、めちゃくちゃ面白かったです。マウスモデルばかりで仕事している身としてはど真ん中の研究です。また、論理的な研究方法がエレガントですし、ガロン酸まで同定していて、その持っていき方するかと驚きました。腸内細菌叢と発がんは大きな話題となっていますが、どの細菌が多いと腫瘍増殖がどうのとか、免疫反応がどうのというような話が多くて、ここまで特定の分子との関わりを解いたのは初めて見ました。大変に勉強になりました。
貴重な報告をありがとうございました。今後ともよろしくお願いいたします。
-
投稿者投稿